
Les effets indésirables les plus fréquents (> 5 %) dans les
phases contrôlées des études cliniques dans le psoriasis, le rhumatisme
psoriasique et la maladie de Crohn avec STELARA® ont été des rhinopharyngites et des céphalées.
La plupart de ces effets indésirables ont été considérés comme étant légers et n’ont pas nécessité l’interruption du traitement.
Les effets indésirables les plus graves rapportés avec STELARA® sont des réactions d’hypersensibilité graves incluant l’anaphylaxie. Le profil de sécurité global était similaire pour les patients atteints de psoriasis, de rhumatisme psoriasique et de maladie de Crohn.
Tableau des effets indésirables
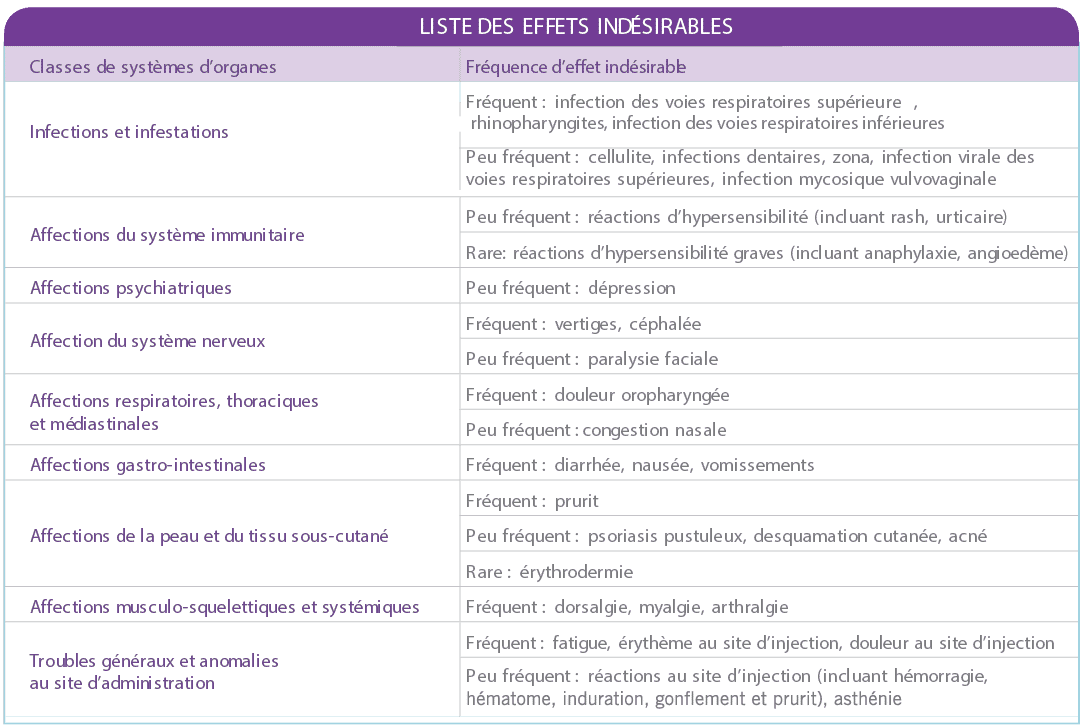
Infections et tumeurs malignes
(incidences dans les phases contrôlées et non contrôlées des études cliniques dans le psoriasis, le rhumatisme psoriasique et la maladie de Crohn)

Infections
Infections par patient-année de suivi

Infection grave par patient-année de suivi
(178 infections graves chez 10 953 patients-années*) * Les infections graves rapportées incluaient abcès anal, cellulite, pneumonie, diverticulite, gastro-entérite et infections virales.

Tumeurs malignes
Tumeurs malignes, excluant les cancers de la peau non-mélanome pour 100 patients-années de suivi. (58 patients pour 10 935 patients-années de suivi)
Cette incidence était comparable à celle attendue dans la population générale (ratio standardisé d’incidence = 0,87 [intervalle de confiance à 95 % : 0,66, 1,14], ajusté à l’âge, au sexe et à l’ethnie). Les tumeurs malignes les plus fréquemment rapportées autre que le cancer de la peau non-mélanome étaient le cancer de la prostate, le mélanome, les cancers colorectaux et du sein.

Cancers de la peau non mélanome pour 100 patients-années de suivi (53 patients sur 10 919 patients-années de suivi)
Le ratio de patients atteints de cancer basocellulaire versus spinocellulaire (4:1) est comparable à celui attendu dans la population générale.
Immunogénicité
Dans les études cliniques sur le psoriasis et le rhumatisme psoriasique, moins de 8 % des patients traités par STELARA® ont développé des anticorps dirigés contre le produit.
Aucune
association apparente n’a été observée entre le développement des
anticorps dirigés contre l’ustekinumab et la survenue de réactions au
site d’injection.
Mises en garde et précautions
Au cours du traitement par STELARA®, risque de survenue :
- d’augmentation du risque d’infections et de réactivation des infections latentes, de graves infections bactériennes, fongiques et virales,
- de tumeurs malignes cutanées et non-cutanées,
- des réactions d’hypersensibilité graves ont été rapportées depuis la mise sur le marché. Des anaphylaxies et angioedèmes sont survenus. En cas de survenue d’une réaction anaphylactique ou d’une autre réaction d’hypersensibilité grave, un traitement approprié doit être instauré et l’administration de STELARA® doit être immédiatement interrompue.
- le protège aiguille de la seringue préremplie est fabriqué à partir de caoutchouc naturel (un dérivé du latex), pouvant provoquer des réactions allergiques chez les personnes allergiques au latex.
- affections graves de la peau : chez les patients atteints de psoriasis, une érythrodermie a été rapportée à la suite d’un traitement par STELARA®. Il faut être vigilant en cas de symptômes de psoriasis érythrodermique ou d’érythrodermie. Si ces symptômes apparaissent, un traitement approprié doit être instauré et STELARA® doit être arrêté en cas de suspicion de réaction médicamenteuse.
STELARA® doit être utilisé avec prudence :
- chez les patients présentant une infection chronique ou des antécédents d’infections récurrentes. Si un patient développe une infection grave, le patient devra être étroitement surveillé et STELARA® ne devra pas être administré avant la guérison complète de l’infection.
- chez les patients avec antécédents de tumeurs malignes ou chez les patients ayant continué leur traitement alors qu’ils avaient développé une tumeur maligne sous STELARA®.
Mises en garde et précautions particulières concernant la tuberculose :
- avant d’initier le traitement par STELARA®, les patients doivent être dépistés pour la tuberculose,
- en cas de tuberculose active, STELARA® ne doit pas être administré,
- en cas de tuberculose latente, un traitement doit être initié avant l’administration de STELARA®,
- un traitement anti-tuberculeux doit également être envisagé avant l’initiation de STELARA® chez les patients ayant des antécédents de tuberculose latente ou active pour lesquels le suivi d’un traitement adapté ne peut être confirmé,
- les patients recevant STELARA® doivent être étroitement surveillés pour dépister les signes et symptômes de tuberculose active pendant et après le traitement.
.png?width=235&height=72&format=png&quality=50)
