Données de tolérance à long terme
Les données de tolérance ont été regroupées à partir de 4 études cliniques : une étude de phase II et 3 études de phase III (PHOENIX 1, PHOENIX 2 et ACCEPT) afin d’évaluer la tolérance de STELARA® chez des patients atteints de psoriasis en plaques modéré à sévère après 5 ans de traitement.

Méthodologie
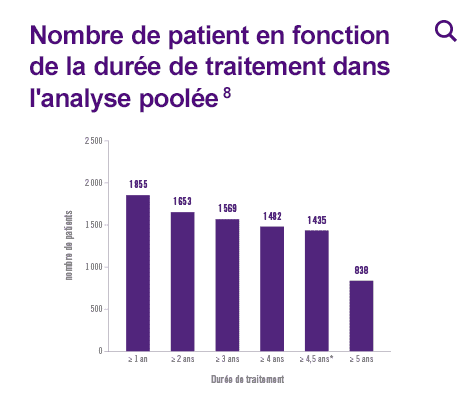
3 117 patients traités par STELARA® soit 8 998 patients-années d’exposition
- Les études cliniques poolées ont été réalisées versus placebo, à l’exception de l’étude ACCEPT qui a été évaluée versus un comparateur actif (etanercept).
- 1 482 patients traités pendant au moins 4 ans et 838 patients traités pendant au moins 5 ans
Les taux d’événements indésirables totaux, d’événements indésirables graves, d’événements indésirables ayant entraîné l’arrêt du traitement et d’événements indésirables présentant un intérêt clinique (infections graves, cancers cutanés non mélanomateux, tumeurs malignes et les événements indésirables cardiovasculaires majeurs) ont été analysés selon la dose de STELARA® reçue (45 mg et 90 mg+), et par année de suivi (année 1 à 5), afin d’évaluer la réponse en fonction des doses administrées et l’impact d’une exposition cumulée sur le long terme.
+ Les événements indésirables de chaque patient ont été comptés séparément, à l’exception des effets indésirables suivants : effets indésirables entraînant l’arrêt du traitement, cancers cutanés non mélanomateux et autres cancers. Pour ces 3 catégories d’effets indésirables, le nombre de patients présentant l’effet considéré a été dénombré.
+ L’usage de STELARA® 90 mg est réservé aux patients ayant un poids >100 kg
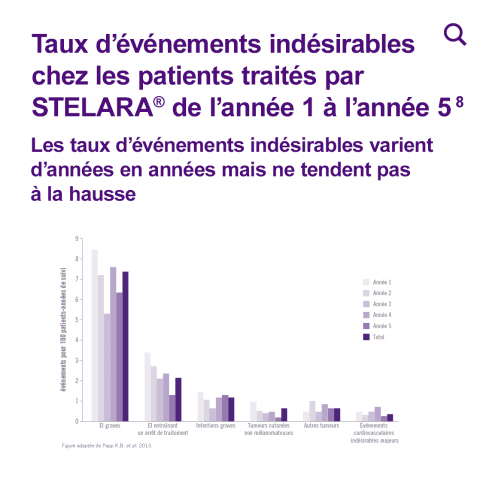
Les données présentées ont inclus tous les patients ayant reçu au moins une dose de STELARA®. Les patients des groupes placebo et etanercept ayant reçu STELARA® après cross over ont été inclus. Les taux d’événements indésirables graves, d’événements indésirables ayant entraîné l’arrêt du traitement et d’événements indésirables présentant un intérêt clinique (infections graves, cancers cutanés non mélanomateux, tumeurs malignes et les événements indésirables cardiovasculaires majeurs) sont restés stables dans le temps entre l’année 1 et l’année 5. Les taux cumulés d’événements indésirables liés à la tolérance étaient globalement comparables entre les patients ayant reçu STELARA® 45 mg et STELARA® 90 mg.+
+L’usage de STELARA® 90 mg est réservé aux patients ayant un poids >100 kg
Pour une information complète sur le profil de tolérance de STELARA®, se référer aux mentions légales du produit en cliquant ici.
Une incidence moyenne d’EI restée stable
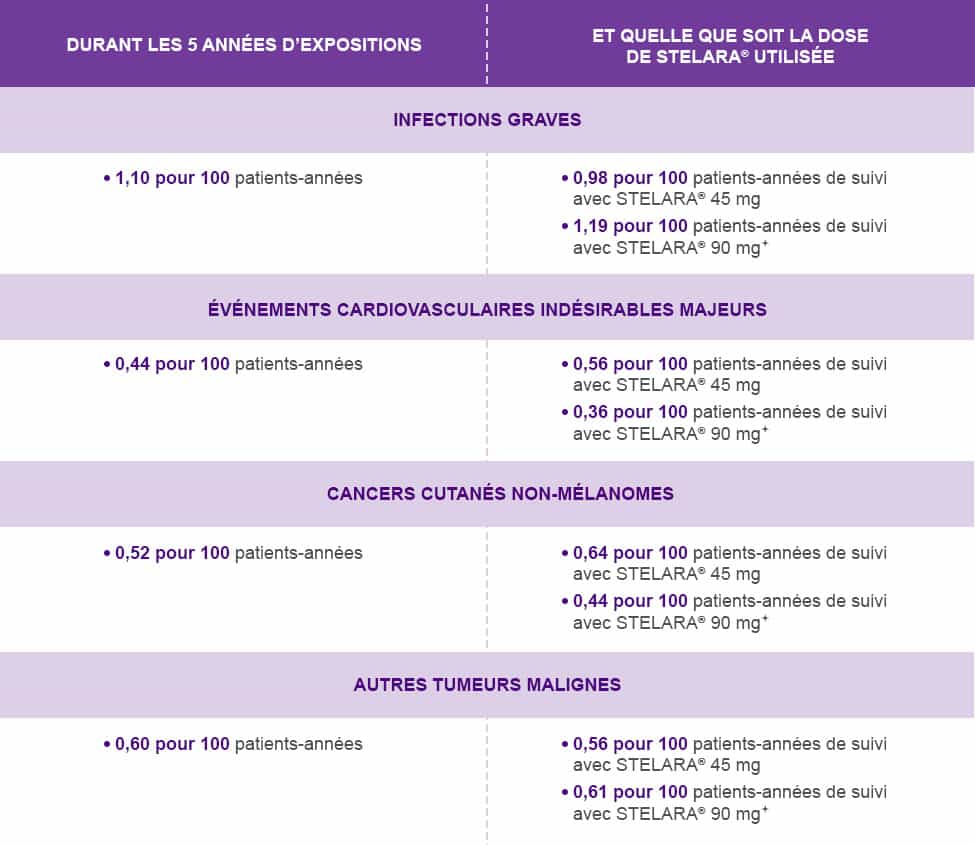
La survenue de tumeurs malignes sous STELARA® 45 mg et STELARA® 90 mg+ est comparable au taux de tumeurs malignes attendu dans la population générale (ratio standardisé d’incidence : 0,98 [IC 95 % 0,74 – 1,29] ajusté à l’âge, au sexe et à l’ethnie). Les tumeurs malignes les plus fréquemment rapportées, autre que le cancer cutané non mélanomateux, étaient des cancers de la prostate (n=14), des mélanomes (n=6), des cancers colorectaux (n=5) et des cancers du sein (n=4).
Pour une information complète sur le profil de tolérance de STELARA®, se référer aux mentions légales du produit en cliquant ici.
+ L’usage de STELARA® 90 mg est réservé aux patients ayant un poids >100 kg
.png?width=235&height=72&format=png&quality=50)
