Etude phoenix 1
Évaluer l’efficacité et la tolérance de STELARA® chez 766 patients adultes avec un diagnostic de psoriasis en plaques modéré à sévère depuis au moins 6 mois et candidats à la photothérapie ou à un traitement systémique.

Méthodologie
Étude internationale de phase III, multicentrique, randomisée, en double aveugle versus placebo jusqu’à 76 semaines avec une phase d’extension en ouvert jusqu’à 264 semaines.
Les patients inclus avaient un score PASI minimum de 12 et une surface corporelle atteinte d’au moins 10%. 53% d’entre eux n’avaient pas répondu, étaient intolérants, ou avaient une contre-indication à un autre traitement systémique à l’inclusion.
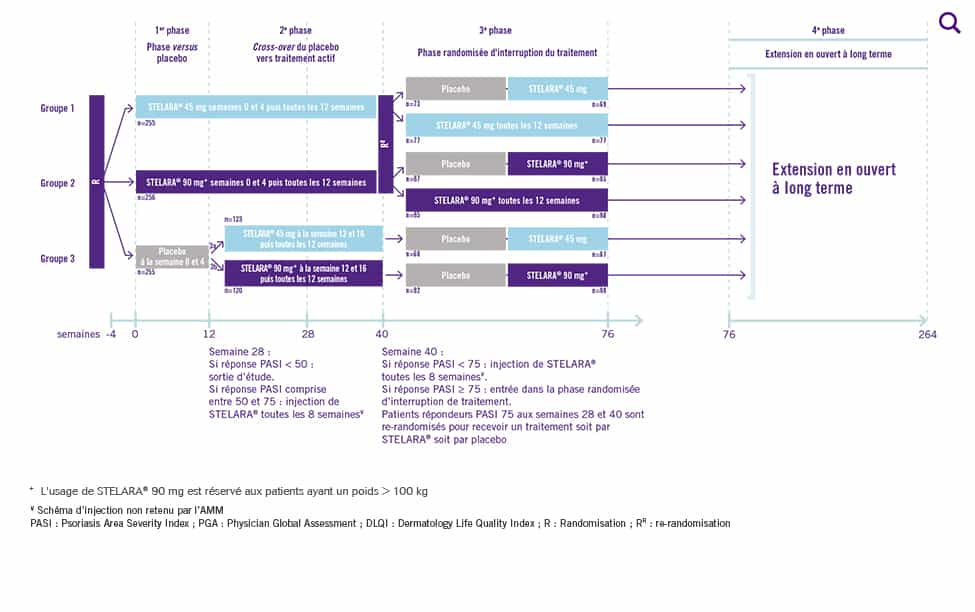
Design de PHOENIX I

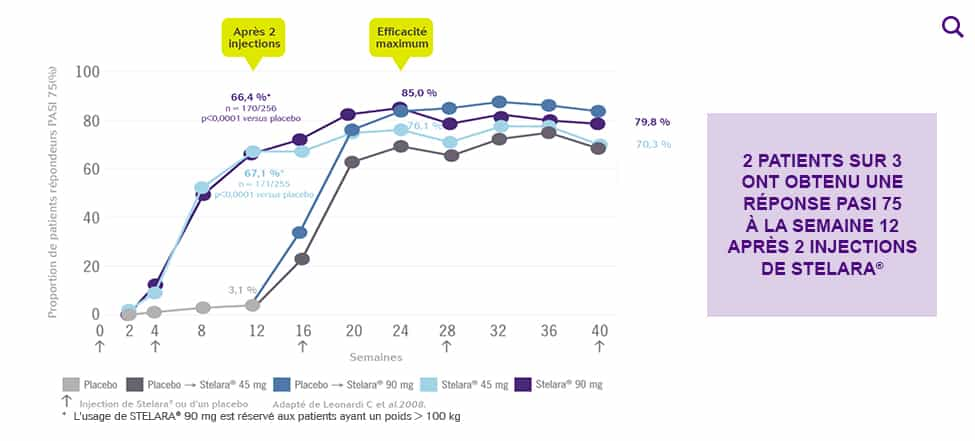
Pourcentage de patient atteignant une réponse PASI 75 à la semaine 12 (amélioration d’au moins 75% du score PASI par rapport à l’inclusion).
Pourcentage de patients répondeurs PASI 75 au cours du temps

Étude phoenix 1 : extension en ouvert
Evaluer l'efficacité et la tolérance de STELARA® chez des patients présentant un psoriasis en plaques modéré à sévère, candidats à une photothérapie ou à un autre traitement systémique, après 5 ans de traitements.
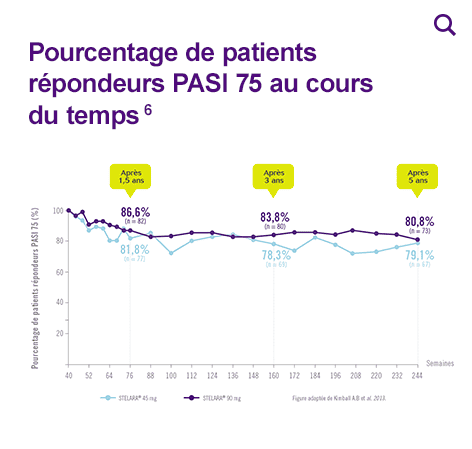
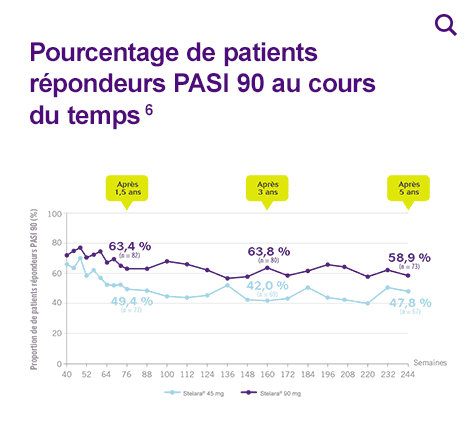
* L’usage de STELARA® 90 mg est réservé aux patients ayant un poids >100 kg
Tolérance de stelara® au cours du temps
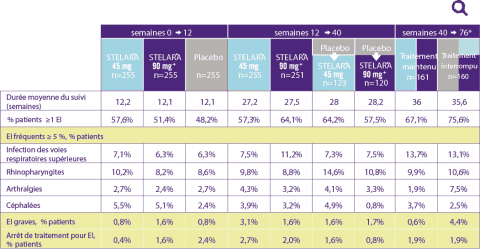
Tolérance de Phoenix I jusqu’à 76 semaines
Effets indésirables
Tolérance de Phoenix I jusqu’à 76 semaines
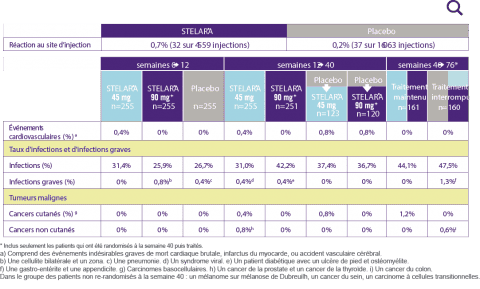
Effets indésirables particuliers
- Dans PHOENIX 1, les effets indésirables les plus fréquents (≥ 5 %) étaient des : rhinopharyngites, infections des voies aériennes supérieures, céphalées, arthralgies.
- Les effets indésirables les plus fréquents (≥ 5 %) ont été considérés comme étant légers et n’ont pas nécessité d’interruption du traitement par STELARA®.
- Le nombre d’infections et d’effets indésirables entraînant l’arrêt du traitement a été similaire dans les différents groupes
*L’usage de STELARA® 90 mg est réservé aux patients ayant un poids >100 kg
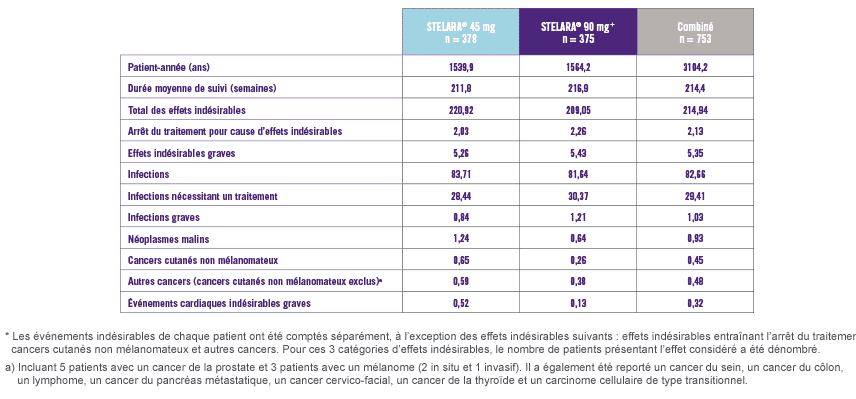
Taux cumulés d’événements indésirables pour 100 patients-années après 5 ans de traitement par STELARA®
Les taux cumulés d’effets indésirables, d’infections, de cancers et d’événements cardiovasculaires sont comparables dans les différents groupes étudiés
Des anticorps dirigés contre l’ustekinumab ont été détectés chez 5,2 % des patients STELARA® :
- Entre la semaine 76 et 148, seul 1 patient a développé des anticorps dirigés contre l’ustekinumab.
- Entre la semaine 148 et 244, aucun patient n’a développé d’anticorps dirigés contre l’ustekinumab.
Aucune association apparente n’a été observée entre le développement des anticorps dirigés contre l’ustekinumab et la survenue de réactions au site d’injection.
Pour une information complète sur le profil de tolérance de STELARA®, se référer aux mentions légales du produit en cliquant ici.
.png?width=235&height=72&format=png&quality=50)
